Dãy chuyển động hóa học tập của kim loại có đặc biệt không? bọn chúng có chân thành và ý nghĩa quan trọng ra sao? bọn chúng được sắp xếp theo trình trường đoản cú nào? có cách như thế nào nhớ cấp tốc và lâu dãy chuyển động hóa học tập của sắt kẽm kim loại lớp 9 không? bài viết sau của Toppy sẽ cho bạn câu vấn đáp nhé!
Dãy hoạt động hóa học tập của kim loại
Dãy chuyển động hóa học tập của kim loại lớp 9 là dãy các kim loại liên tiếp được sắp xếp theo trình tự giảm dần dựa vào mức độ hoạt động của chúng. Dãy vận động kim nhiều loại tạo thành bởi phương pháp thực nghiệm hóa học.
Bạn đang xem: Dãy kim loại hóa học

Dãy hoạt dộng chất hóa học của kim loại
Dãy chuyển động này giúp ta thuận tiện dự đoán được sắt kẽm kim loại đó công dụng với các chất khác sẽ tạo ra công dụng gì. Mặc dù nhiên, ta thấy rằng những kim loại này được những nhóm như sau: sắt kẽm kim loại yếu, kim loại mạnh nhất, sắt kẽm kim loại trung bình và sắt kẽm kim loại mạnh.
Dãy vận động hóa học của kim loại đầy đủ chuẩn chỉnh quốc tế:
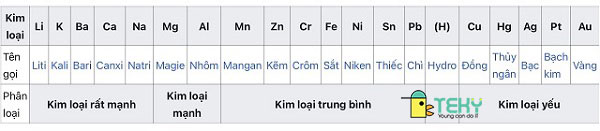
Ý nghĩa hàng hoạt động
Như đã ra mắt ở trên, dãy hoạt động hóa học của sắt kẽm kim loại được khối hệ thống và bố trí theo trình tự sút dần dựa vào mức độ hoạt động (tức khả năng phản ứng với chất khác). Và chúng được tạo nên thành bởi phương thức thực nghiệm hóa học. Từ đó ta có được một số ý nghĩa chính như sau:
Khả năng bội nghịch ứng cùng với nước
Ý nghĩa đặc thù nhất của dãy vận động này là phản bội ứng với nước. 5 kim loại mạnh mẽ nhất đứng đầu dãy dễ dàng phản ứng cùng với nước trong đk thường. Kim loại từ Magie (Mg) trở sau đây khó phản ứng hơn, như sắt (Fe) tác dụng với nước được nhưng buộc phải ở điều kiện là nhiệt độ cao. Hoặc sắt kẽm kim loại như quà (Au), Chì (Pb), Thiếc (Sn),… không có phản ứng với nước trong phần lớn điều kiện.
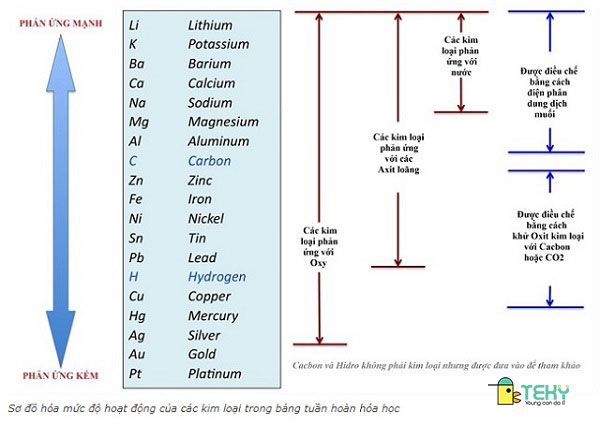
Sơ vật dụng hóa cường độ hoạt động
Kim một số loại phản ứng với nước công dụng tạo thành bazơ tương xứng và tạo thành khí Hidro (H2).
Ví dụ:
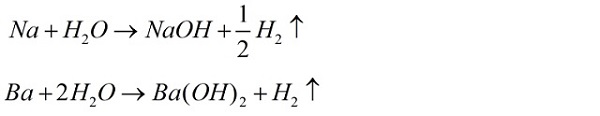
Phương trình hóa học kim loại phản ứng cùng với nước
Tác dụng với Oxi
Các sắt kẽm kim loại mạnh làm phản ứng dễ ợt với oxi trong điều kiện thường. Vì vậy, các kim các loại này ở quanh đó không khí sống dạng hợp chất. Một số kim loại chỉ phản bội ứng với oxi lúc có ánh sáng cao như đồng và các kim nhiều loại trung bình. Một vài sắt kẽm kim loại ở bên cạnh không khí phản ứng sinh sản thành hợp chất oxit với bị mất dần những đặc điểm ban đầu. Lấy ví dụ như như kim loại sắt ở môi trường không khí lâu sẽ tạo nên ra Fe2O3 làm sắt trở đề xuất giòn và dễ gãy, hiện tượng này được call là gỉ sét.Các sắt kẽm kim loại yếu sót lại phản ứng với oxi rất khó như bội nghĩa (Ag), Bạch kim (Pt), kim cương (Au),…Ví dụ:
3Fe + 2O2 → Fe3O4 (trong điều kiện nhiệt độ)
4Al + 3O2 → 2Al2O3 (trong đk nhiệt độ)
Phản ứng với hỗn hợp axit
Các sắt kẽm kim loại trung bình và kim loại mạnh làm phản ứng với hỗn hợp axit sinh sản thành muối và khí hidro (H2). Bởi vậy, trong thí nghiệm một số trong những kim một số loại được thực hiện để pha chế ra khí hidro (H2), một trong những kim loại đó là sắt (Fe), Kẽm (Zn), Nhôm (Al).
Zn + 2HCl → n
Cl2 +H2
Các kim loại yếu không phản ứng được với axit loãng. Sát bên đó, một vài sắt kẽm kim loại có thể tác dụng được cùng với axit sệt như Đồng (Cu), bội bạc (Ag). Bọn chúng phản ứng với axit H2SO4 (đặc với nóng) hoặc axit HNO3 (đặc hay loãng) tạo thành thành dung dịch muối mới và khí sunfurơ hoặc khí NO xuất xắc NO2 .
Cu + 2H2SO4 → Cu
SO4 + 2H2O + SO2
Kim loại tác dụng với muối
Một chân thành và ý nghĩa đặc trưng tiếp theo sau được tạo nên từ dãy vận động hóa học tập của kim loại chính là tác dụng với muối. Phản ứng này chỉ xảy ra khi đáp ứng được các điều kiện như sau:
Kim loại 1-1 chất bắt buộc phải đứng trước sắt kẽm kim loại trong hợp hóa học (được xét theo địa chỉ trong dãy hoạt động hóa học)Kim loại đối kháng chất đề xuất nằm sau Mg trong dãy vận động kim loại, ví dụ như Mg, Zn, Al,…Ví dụ: Phương trình phản bội ứng
Mg + Fe
Cl2 → Mg
Cl2 + Fe
Hoạt động sút dần theo hướng từ trái lịch sự phải
Độ chuyển động kim một số loại hay còn được gọi là khả năng bội phản ứng của kim loại. Trong dãy hoạt động hóa học của kim loại đầy đủ phản ứng sút dần từ sắt kẽm kim loại Liti (Li) tới kim loại Vàng (Au). Phản ứng đặc thù nhất là tác dụng với nước.

Hoạt động giảm dần theo chiều từ trái quý phái phải
5 kim loại vượt trội nhất đứng đầu dãy tiện lợi phản ứng với nước trong đk thường. Kim loại từ Magie (Mg) trở sau đây khó bội nghịch ứng hơn, như fe (Fe) công dụng với nước được nhưng nên ở điều kiện là ánh sáng cao. Hoặc sắt kẽm kim loại như đá quý (Au), Chì (Pb), Thiếc (Sn),… không có phản ứng với nước trong hồ hết điều kiện.
Cách nhớ nhanh và lâu dãy vận động hóa học của kim loại
Cách nhớ cấp tốc và thọ dãy vận động kim các loại này khá 1-1 giản. Lời khuyên nhủ dành cho chính mình là hãy áp dụng thơ văn vào tên của những kim các loại này, bí quyết học này rất hay và dễ nhớ. Bài thơ dưới đây được phần nhiều người đánh giá là đơn giản dễ dàng và dễ dàng thuộc nhất, mời chúng ta tham khảo:
K – khi; mãng cầu – nào; bố – ba; Ca – cần; Mg – may; Al – áo; Zn – giáp; sắt – sắt; Ni – nhớ; Sn – sang; H – hỏi; Cu – cửa; Hg – hàng; Ag – á; Pt – phi; Au – âu.
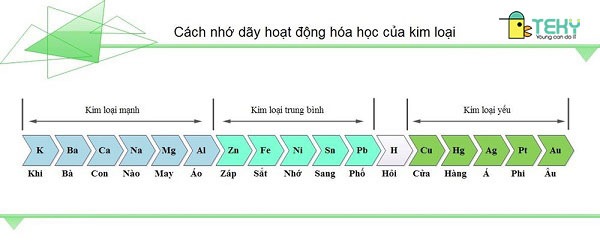
Cách ghi nhớ dãy chuyển động kim loại
Bài viết trên đây sẽ cung cấp cho bạn đọc những kiến thức và kỹ năng cơ bản về dãy vận động hóa học của kim loại, bọn chúng được vận dụng trong đời sống cùng sản xuất như vậy nào. Hy vọng nội dung bài viết của chúng tôi sẽ giúp đỡ bạn học tập với nghiên cứu được không ít kiến thức. Chúc các bạn thành công!
Giải pháp trọn vẹn giúp con đạt điểm 9-10 dễ dãi cùng Toppy
Với kim chỉ nam lấy học sinh làm trung tâm, Toppy chú trọng câu hỏi xây dựng cho học viên một lộ trình học tập cá nhân, giúp học viên nắm vững căn bạn dạng và tiếp cận loài kiến thức nâng cấp nhờ hệ thống nhắc học, thư viện bài xích tập và đề thi chuẩn chỉnh khung năng lượng từ 9 lên 10.
Kho học tập liệu khổng lồ
Kho đoạn clip bài giảng, câu chữ minh hoạ sinh động, dễ hiểu, gắn kết học sinh vào hoạt động tự học. Thư viên bài tập, đề thi phong phú, bài tập tự luyện phân cấp những trình độ.Tự luyện – trường đoản cú chữa bài xích giúp tăng tác dụng và rút ngắn thời gian học. Kết hợp phòng thi ảo (Mock Test) có giám thị thật để chuẩn bị sẵn sàng và toá gỡ nỗi lo lắng về bài bác thi IELTS.

Học online thuộc Toppy
Nền tảng tiếp thu kiến thức thông minh, ko giới hạn, cam kết hiệu quả
Chỉ cần điện thoại thông minh hoặc thứ tính/laptop là chúng ta có thể học bất kể lúc nào, bất cứ nơi đâu. 100% học viên tận hưởng tự học thuộc TOPPY phần đông đạt công dụng như mong mỏi muốn. Các năng lực cần tập trung đều được nâng cao đạt hiệu quả cao. Học tập lại miễn tầm giá tới khi đạt!
Tự động cấu hình thiết lập lộ trình học tập tối ưu nhất
Lộ trình học tập cá thể hóa cho từng học viên dựa trên bài đánh giá đầu vào, hành vi học tập, kết quả luyện tập (tốc độ, điểm số) bên trên từng đơn vị kiến thức; từ bỏ đó triệu tập vào các tài năng còn yếu ớt và phần đông phần kiến thức học viên chưa cố gắng vững.
Trợ lý ảo và cố gắng vấn học tập Online đồng hành cung cấp xuyên suốt quy trình học tập
Kết hợp với ứng dụng AI nói học, đánh giá học tập thông minh, cụ thể và đội ngũ cung ứng thắc mắc 24/7, giúp kèm cặp và đụng viên học sinh trong suốt quy trình học, tạo ra sự im tâm phó thác cho phụ huynh.
Bài giảng hàng điện hóa của kim loại đầy đủ, áp dụng làm bài xích tậpDãy năng lượng điện hóa của kim loại là phần lý thuyết đặc trưng xuất hiện nay nhiều trong những đề thi học kỳ, đh và học sinh giỏi. Nội dung bài viết ngày hôm nay tienthanh.edu.vn sẽ share bài giảng hàng điện hóa của kim loại đầy đủ, dễ dàng thuộc, dễ dàng nhớ để áp dụng vào làm bài bác thi chính xác nhất.
1. Hàng điện hóa của sắt kẽm kim loại là gì?

Dãy điện hóa là gì? kim chỉ nan bài tập vận dụng
Nắm vững những lý thuyết dãy năng lượng điện hóa sắt kẽm kim loại sẽ giúp chúng ta học sinh kết thúc tốt những bài tập hóa vô cơ. Vào hóa học, cation kim loại có thể nhận electron để trở nên nguyên tử kim loại, ngược lại, những nguyên tử kim loại có thể nhường electron để tạo thành các cation kim loại, ví dụ như như:
Cu2+ + 2e ↔ Cu
Ag+ + 1e ↔ Ag
Định nghĩa dãy điện hóa của sắt kẽm kim loại là đều cặp oxi hóa – khử của sắt kẽm kim loại được sắp xếp theo chiều tăng cao tính lão hóa của ion sắt kẽm kim loại và bớt dần của tính khử kim loại.
2. Hàng điện hóa kim loại tương đối đầy đủ nhất
Sắp xếp theo tính lão hóa của sắt kẽm kim loại tăng:
K+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+ Au3+
Săp xếp theo tính khử của kim loại tăng: K na Mg Al Zn sắt Ni Sn Pb H Cu Ag Au


3. Ý nghĩa hàng điện hóa của kim loại
Dựa vào hàng điện hóa sắt kẽm kim loại ta có thể biết được các cặp chất nào sẽ tính năng được cùng với nhau, qua đó sẽ dự đoán được phần nhiều yếu tố sau đây:
So sánh tính oxi hóa – khử: Tính lão hóa của ion kim loại Mn+càng mạnh mẽ thì tính khử càng yếu và ngược lạiXác định được chiều bội phản ứng của lão hóa – khử: dự đoán được chiều của bội phản ứng thân hai cặp thoái hóa – khử theo luật lệ alpha.Xét một cặp làm phản ứng lão hóa khử: hóa học khử bạo gan + chất oxi hóa mạnh mẽ ; chất oxi hóa yếu rộng + chất khử yếu đuối hơn.

Ý nghĩa của dãy điện hóa kim loại
4. đặc thù của sắt kẽm kim loại trong hàng điện hóa
Dựa vào dãy điện hóa đầy đủ, bạn có thể xác định được các đặc thù hóa học của những kim loại, nhất là xác định được xem oxi hóa và tính khử.

Tính hóa học dãy điện hóa của kim loại đầy đủ
4.1. Phản ứng cùng với phi kim
Một số kim loại trong dãy điện hóa bao gồm tham gia bội phản ứng với phi kim nhằm tạp ra các muối tương ứng. Một trong những phi kim hay chạm mặt đó là oxi, clo, lưu huỳnh .
Xem thêm: Hướng Dẫn Cách Đánh Mắt Đẹp Tự Nhiên Như Sao Hàn, 5 Bước Trang Điểm Mắt Đơn Giản Chỉ Trong 3 Phút
Ví dụ:
Kim một số loại + Clo: 2Fe + Cl2 -> 2FeCl3Kim một số loại + oxi: 4Al + O2 -> 2Al2O3Kim nhiều loại + lưu huỳnh: Hg + S -> Hg
S
4.2. Bội phản ứng với axit
Khá nhiều sắt kẽm kim loại tham gia phản ứng với những dung dịch axit tạo nên muối kết phù hợp với việc giải hòa khí hoặc nước.
Ví dụ:
Fe + 2HCl -> Fe
Cl2 + H2 (HCl loãng)
3Cu + HNO3 -> 3Cu
SO4 +2NO + 4H2O, (HNO3 loãng)
4.3. Phản ứng cùng với nước
Những sắt kẽm kim loại thuộc đội IA, IIA tham gia phản ứng cùng với nước tạo ra dung dịch kiềm với khí hidro.
Ví dụ:
2Na + 2H2O -> 2Na
OH + H2 (khí)
4.4. Phản bội ứng cùng với muối
Kim loại tính năng với muối chế tạo muối mới và kim loại mới
Ví dụ:
Fe + Cu
SO4 -> Fe
SO4 + Cu
5. Bí quyết đọc hàng điện hóa dễ dàng thuộc
tienthanh.edu.vn chia sẻ một số giải pháp nhớ hàng điện hóa bằng các vần thơ. Những kim loại đứng trước có tính khử mạnh hơn những sắt kẽm kim loại đứng sau nó. Hồ hết cation mức giá sau tất cả tính lão hóa mạn hơn gần như cation phía trước.



6. Bài bác tập về dãy điện hóa của kim loại

Bài tập hàng điện hóa kim loại
Bài tập 1: Hãy xác gắn thêm tính oxi hóa sút dần tính của những ion kim loại sau: Mg2+, Fe3+, Fe2+
Lời Giải: phụ thuộc vào dãy điện hóa đầy đủ, ta khẳng định được tính oxi hóa sút dần của các kim các loại như sau: Fe3+, Fe2+, Mg2+.
Bài tập 2: khẳng định chiều bội nghịch ứng thân hai cặp Fe2+/ Fe với Cu2+/ Cu.
Lời Giải:
Theo trơ thổ địa tự ta gồm cặp Fe2+/ sắt đứng trước cặp Cu2+/ Cu. Áp dụng luật lệ alpha tác tất cả chiều làm phản ứng sau:
Cu2+ + fe → Cu + Fe2+
Như vậy, bội nghịch ứng xảy ra theo chiều ion Cu2+ oxi hóa fe để sản xuất thành Cu với Fe2+
Bài tập 3: Hãy tìm xem phản ứng nào tiếp sau đây không thể xảy ra.
A. Cu2++ Mg → Cu + Mg2+
B. Cu + Zn2+→ Cu2++ Zn
C. Cu2++ fe → Cu + Fe2+
D. Cu + 2Ag+→ Cu2++ 2Ag
Lời Giải: Đáp án B không xảu ra vì tính lão hóa của Zn2+ yếu rộng Cu2+, cho nên Zn2+ thiết yếu oxi hóa được Cu thành Cu2+.
Bài tập 4: Hãy xác minh tính oxi hóa giảm dần của những ion kim loại sau đây: Mg2+, Fe3+, Fe2+, Cu2+, Ag+
Lời Giải:
Dựa vào dãy điện hóa ta xác định được tính oxi hóa sút dần của những ion kim loại: Ag+, Fe3+, Cu2+, Fe2+, Mg2+.
Bài tập 5: Hãy xác định tính khử giảm dần của các kim các loại sau: Fe, Al, Cu, Ag, Zn
Lời Giải:
Trong hàng điện hóa của kim loại, những chất được sắp xếp theo sản phẩm công nghệ tự sau: Al, Zn, Fe, Cu, Ag.
Vậy tính khử giảm dần sẽ lè: Al, Zn, Fe, Cu, Ag.
Bài tập 6: cho các kim một số loại Zn, Cu, Mg, Al. Hãy xác minh tính oxi hóa của ion kim loại tăng dần.
Lời Giải:
Dựa vào hàng điện hóa rất đầy đủ nhất ta có chiều bớt dần của tính khử là: Mg, Al, Zn, Cu.
Vậy chiều tăng dần đều tính lão hóa của kim loại sẽ là: Mg2+ 3+ 2+ 2+
Bài tập 7: triển khai ngâm đinh sắt trong 200 ml hỗn hợp Cu
SO4, sau thời điểm xảy ra phản nghịch ứng ta mang đinh sắt ra rửa và làm cho khô thấy m
Fe tăng 0,8 gam. Hãy xác định nồng độ Cu
SO4.
Lời Giải:
Fe + Cu
SO4 → Fe
SO4 + Cu
Ta có: mđinh sắt tăng = m
Cu xuất hiện (bám vào) – m
Fe pư
Gọi số mol là a, ta được: 0,8 = 64a – 56a → a = 0,1 mol =>
CM(Cu
SO4) = 0,1/0,2 = 0,5M
Hy vọng với bài giảng dãy điện hóa của kim loại trên đây để giúp đỡ bạn đọc tất cả thêm kiến thức hóa học ứng dụng vào làm bài tập một cách đúng mực nhất. Bài viết liên quan các dạng bài hóa học tập tại wevsite tienthanh.edu.vn.








